Taq DNA Polymerase (P1011-P1012-P1013-P1014-P1015)

Taq DNA Polymerase (P1011-P1012-P1013-P1014-P1015)
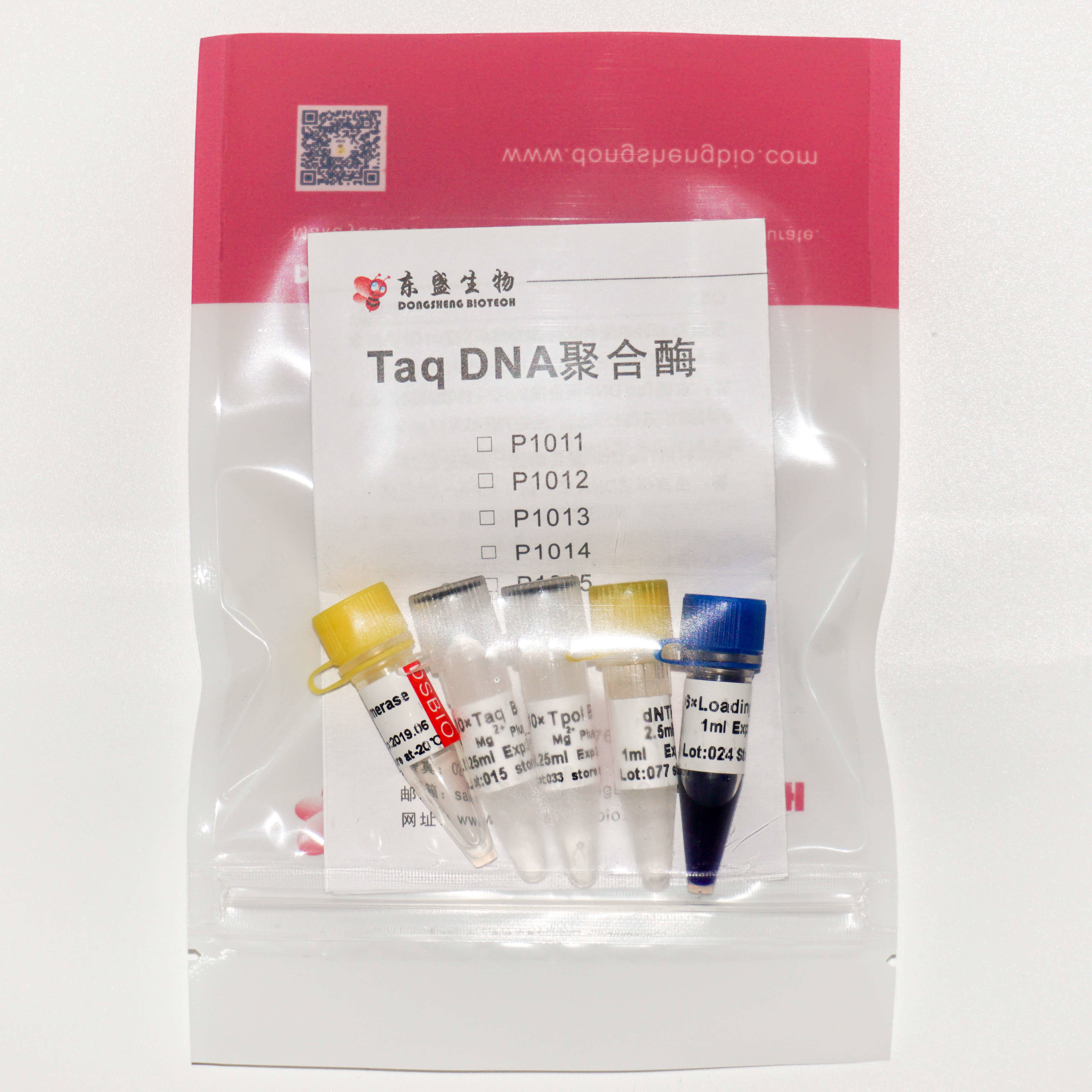
Taq DNA Polymerase
Cat. #:P1011,P1012,P1013,P1014,P1015
产品概况
Taq DNA Polymerase是嗜热性细菌Thermus aquaticus来源的热稳定重组型Taq DNA聚合酶,分子量为94 KD。扩增片段的长度可达10 kb(简单模板)。延伸速度为1min/kb(70~75℃,简单模板可达10s/kb)。该酶具有5'→3'聚合酶活性,无3'→5'外切酶活性。扩增产物具有3'-dA,可直接用于TA克隆。
产品组成
Component | P1011 500U | P1012 500U | P1013 1,000U | P1014 1,000U | P1015 12,000U |
Taq DNA Polymerase(5U/μl)[1] | 100 μl | 100 μl | 200 μl | 200 μl | 100 μl × 24 |
10× Taq Buffer(Mg2+ Plus)[2] | 1.25 ml | 1.25 ml | 1.25 ml × 2 | 1.25 ml × 2 | 1.25 ml × 24 |
10× Tpol Buffer(Mg2+ Plus)[2] | 1.25 ml | 1.25 ml | 1.25 ml × 2 | 1.25 ml × 2 | 1.25 ml × 24 |
6× Loading Buffer[3] | 1 ml | 1 ml | 1 ml | 1 ml | - |
dNTPs(2.5mM)[4] | - | 1 ml | - | 1 ml × 2 | - |
[1] 提供5U/μl和2.5U/μl两种活性单位的包装可供选择,如无特别说明默认5U/μl。
[2] 10× Taq Buffer和10× Tpol Buffer 分为Mg2+ Plus与Mg2+ Free两种包装可供选择,如无特别说明默认Mg2+ Plus。Mg2+ Free的10× Taq Buffer提供25mM MgCl2,Mg2+ Free的10× Tpol Buffer提供25mM MgSO4。Taq Buffer能满足大多数常规PCR反应,优先使用此Buffer。Tpol Buffer对于提高PCR特异性有显著作用。
[3] P1015不含6× Loading Buffer,如有需要请单独购买(Cat. #:M9041)。
[4] dNTPs是dATP、dGTP、dCTP和dTTP等摩尔混合物,P1011/P1013/P1015不含dNTPs,如有需要请单独购买(Cat. #: P9011/P9012/P9013)。
活性定义
一个活性单位(U)指用活性化的大马哈鱼精子DNA作为模板/引物,在72℃、30 min内,摄入10 nmol全核苷酸所需的酶量。
保存条件
-20℃保存2年。







 电话:020-87791356(国内业务) 020-31600213(海外业务)
电话:020-87791356(国内业务) 020-31600213(海外业务) 销售邮箱:sales@gdsbio.com
销售邮箱:sales@gdsbio.com  技术支撑:technique@gdsbio.com
技术支撑:technique@gdsbio.com